
10. Sınıf Kimya Ders Kitabı Cevapları Başak Yayınları Sayfa 100


“10. Sınıf Kimya Ders Kitabı Cevapları Sayfa 100 Başak Yayınları” ulaşabilmek ve dersinizi kolayca yapabilmek için aşağıdaki yayınımızı mutlaka inceleyiniz.
10. Sınıf Kimya Ders Kitabı Cevapları Başak Yayınları Sayfa 100
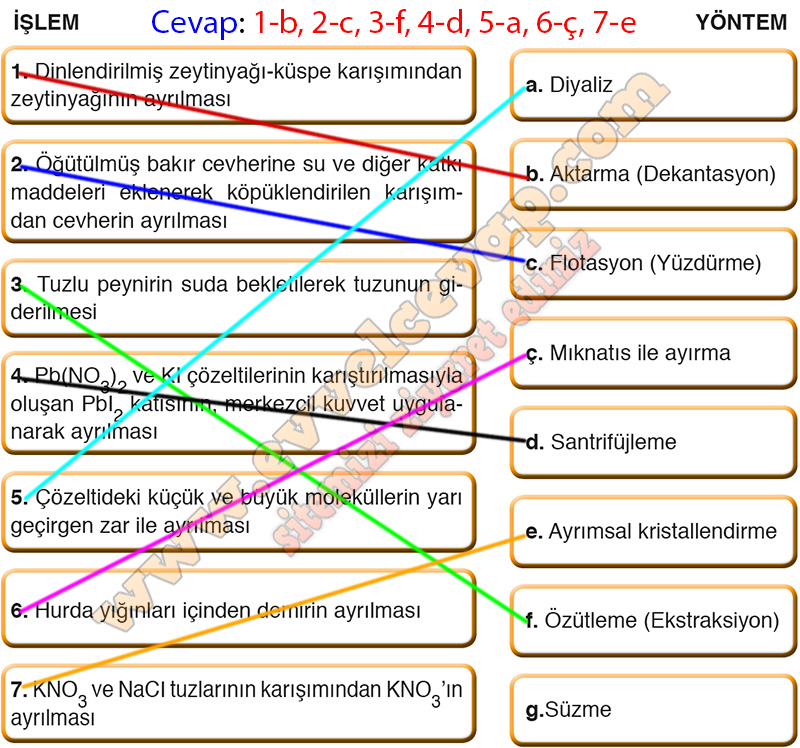
C. Aşağıda verilen işlemleri, uygun yöntemler ile eşleştiriniz.
- Cevap:
Ç. Aşağıda verilen soruların cevaplarını defterinize yazınız.
1. Heterojen karışımları, dağılan maddenin ve dağılma ortamının fiziksel hâline göre sınıflandırıp üçer örnek veriniz.
- Cevap:
Sınıflandırıp 3 örnek hazırladık:
- Katı-Katı: Kum ve tuz karışımı, granit, demir ve kükürt karışımı.
- Katı-Sıvı: Kumlu su, süt (yağ taneleri içerir), reçel.
- Katı-Gaz: Toz fırtınası, duman, polenli hava.
2. Hidratasyon ve solvatasyon nedir? Aralarındaki farkı açıklayarak NaCl ve K2SO4 tuzlarının hidratasyonu sırasında iyonlarla çözücünün durumunu modelle gösteriniz.
- Cevap: Hidratasyon, bir iyonun veya molekülün su molekülleri tarafından çevrelenmesi işlemidir. Solvatasyon, hidratasyonun genel adıdır ancak çözücü herhangi bir sıvı olabilir. Fark, hidratasyon sadece su için geçerliyken solvatasyon her türlü çözücü için geçerlidir. NaCl hidratasyonunda, Na+ iyonları suyun oksijen atomları, Cl- iyonları suyun hidrojen atomları tarafından çevrelenir. K2SO4‘te ise K+ iyonları suyun oksijen atomları tarafından, SO42- iyonları hem hidrojen hem de oksijen atomları tarafından çevrelenir.
3. Çözünme olayında “Benzer, benzeri çözer.” kuralını ve moleküller arası etkileşimleri göz önüne alarak aşağıda verilen madde çiftlerinin birbiri içinde çözünüp çözünmediklerini belirtiniz.
• Etil alkol (C2H5OH) ve su (H2O)
- Cevap: Çözünür. Etil alkolde hidroksil (-OH) grubu ve su molekülü arasında hidrojen bağı oluşabilir. Dolayısıyla etil alkol su içinde çözünür.
• Katı iyot (I2) ve su (H2O)
- Cevap: Çözünmez. İyot molekülleri arasındaki etkileşim Van der Waals kuvvetleridir ve su molekülleri arasındaki hidrojen bağlarıyla kıyaslandığında bu etkileşimler zayıftır. İyot, su içinde iyi bir şekilde çözünmez.
• Potasyum iyodür (KI) ve etil alkol (C2H5OH)
- Cevap: Sınırlı çözünürlük. KI iyonik bir bileşiktir ve etil alkol moleküler bir çözücüdür. Genel olarak, iyonik bileşikler moleküler çözücülerde çok az çözünür, ancak KI, etil alkol içinde sınırlı bir çözünürlüğe sahiptir.
• Karbon tetraklorür (CCl4) ve benzen (C6H6)
- Cevap: Çözünür. Her iki madde de polar olmayan moleküllerdir ve aralarında Van der Waals etkileşimleri oluşur. Bu nedenle karbon tetraklorür benzen içinde çözünür.
• Karbon tetraklorür (CCl4) ve su (H2O)
- Cevap: Çözünmez. Karbon tetraklorür polar olmayan bir bileşiktir, su ise polar bir bileşiktir. Polar ve polar olmayan maddeler genellikle birbiri içinde çözünmez. Bu nedenle karbon tetraklorür su içinde çözünmez.
10. Sınıf Başak Yayınları Kimya Ders Kitabı Sayfa 100 ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.












































