
9. Sınıf Kimya Evrensel İletişim Yayınları Ders Kitabı Cevapları Sayfa 125


9. Sınıf Kimya Ders Kitabı Sayfa 125 Cevapları Evrensel İletişim Yayınları’na ulaşabilmek ve dersinizi kolayca yapabilmek için aşağıdaki yayınımızı mutlaka inceleyiniz.
9. Sınıf Kimya Evrensel İletişim Yayınları Ders Kitabı Cevapları Sayfa 125
1. Aşağıda verilen molekül çiftleri arasında oluşabilecek etkileşim türlerini belirleyiniz. (1H, 6C, 7N, 8O, P) a) H2O(s) – NH3(s) b) CH4(s) – CH4(s) c) PH3(s) – CO(s)
- Cevap:
a) H2O(s) – NH3(s)
Bu iki molekül arasında Hidrojen Bağ’ı oluşabilir. H2O, NH3 ve HF gibi bileşik moleküllerinde bulunan hidrojen atomları N, O veya F atomlarından birisine bağlı olduğu için bu moleküller arasında hidrojen bağları oluşur Dipol-dipol etkileşim de oluşabilir. Polar yapılı moleküllerde, molekülün zıt kutupları arasında oluşan elektrostatik çekim kuvveti dipol-dipol etkileşimidir. H2O, H2S, NH3, HCl, HCN, PH3 gibi polar karakterli kovalent moleküllerde dipol-dipol etkileşimi görülür.
b) CH4(s) – CH4(s)
Bu iki molekül arasında indüklenmiş dipol-indüklenmiş dipol etkileşimleri (London Kuvvetleri) oluşabilir. CH4, CO2 gibi apolar yapılı bileşik moleküllerinin yapısında yoğun fazlarda geçici dipol yapı oluşur. Bu geçici dipol yapı, türler arasında bir çekim kuvveti oluşmasını sağlar. Geçici dipol yapıdan dolayı oluşan çekim kuvvetine indüklenmiş dipol-indüklenmiş dipol etkileşimleri oluşur.
c) PH3(s) – CO(s)
Bu iki molekül arasında Dipol-Dipol Etkileşimleri oluşabilir. Polar yapılı moleküllerde, molekülün zıt kutupları arasında oluşan elektrostatik çekim kuvveti dipol-dipol etkileşimidir. H2O, H2S, NH3, HCl, HCN, PH3 gibi polar karakterli kovalent moleküllerde dipol- dipol etkileşimi görülür. London kuvvetleri de oluşabilir. CH4, CO2 gibi apolar yapılı bileşik moleküllerinin yapısında yoğun fazlarda geçici dipol yapı oluşur. Bu geçici dipol yapı, türler arasında bir çekim kuvveti oluşmasını sağlar.
Aşağıdaki tabloda verilen türlerde, moleküller arasında bulunan zayıf çekim kuvvetlerini işaretleyiniz.
- Cevap:
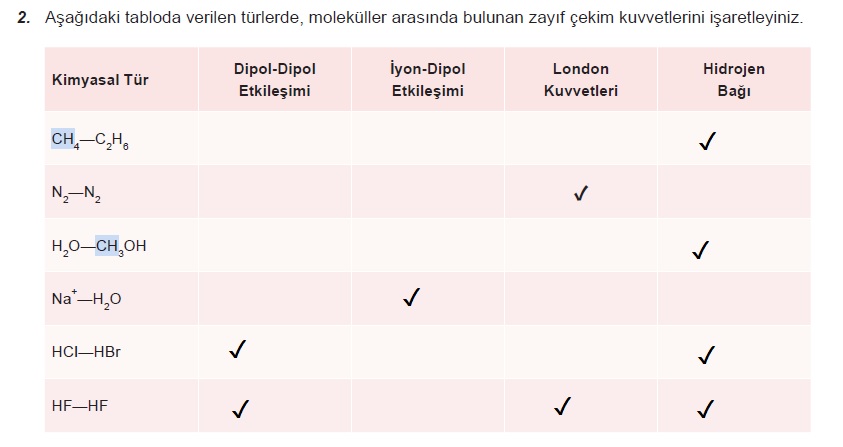
Açıklama: CH4, SiH4, GeH4 ve SnH4 molekülleri apolar karakterlidir. Kendi molekülleri arasında sadece London kuvvetleri bulunduğundan diğer gruplardaki bileşiklere göre kaynama noktaları düşüktür. 4A grubu bileşiklerinde elektron yoğunluğu arttıkça London kuvvetleri arttığından CH4, SiH4, GeH4 ve SnH4 sıralamasında bileşiğin kaynama noktasında artış gözlenir.
H2O, NH3 ve HF gibi bileşik moleküllerinde bulunan hidrojen atomları N, O veya F atomlarından birisine bağlı olduğu için bu moleküller arasında hidrojen bağları oluşur.
Kalıcı dipol yapının oluşması için molekülün polar karakterde olması gerekir. Polar kovalent bağ içeren iki atomlu moleküllerde kalıcı dipoller vardır. HF, HCl, HBr gibi moleküller polar karakterdedir ve kalıcı dipoller içerir. Polar yapılı moleküllerde, molekülün zıt kutupları arasında oluşan elektrostatik çekim kuvveti dipol-dipol etkileşimidir. H2O, H2S, NH3, HCl, HCN, PH3 gibi polar karakterli kovalent moleküllerde dipol- dipol etkileşimi görülür.
Yemek tuzu (NaCl) iyonik bir bileşiktir ve suda iyonlarına ayrışarak çözünür. Bu çözünme sonucunda pozitif yüklü sodyum iyonu (Na+) ve negatif yüklü klorür iyonu (Cl–) oluşur. Şekil 3.9’da Na+ ve Cl– iyonları ile H2O molekülleri arasında oluşan iyon-dipol etkileşimleri görülmektedir.
3. Aşağıdaki cümlelerin sonundaki kutucuklara ifade doğru ise “D”, yanlış ise “Y” yazınız.
(Y) a. Oluşumundaki enerji değişimi 40 kJ/mol değerinden büyük olan olaylarda kesinlikle güçlü etkileşimler kopmuş ve oluşmuştur.
Açıklama: Örneğin sıvı hâldeki suyun gaz hâle gelmesi için 43,9 kJ/mol enerji gerekir. Olay fiziksel bir değişim olup moleküller arası etkileşimler kopmuştur. Ancak gereken enerji 40 kJ/mol değerinden büyüktür. Bilinmelidir ki 40 kJ/mol ölçütü kabul edilen bir değerdir. Bu enerji değerine uymayan değişimler de vardır. Kimyasal değişimlerde iyonik veya kovalent bir bileşikteki atomlar arası etkileşimler kopar veya oluşur. Bu etkileşimler güçlü etkileşimlerdir. Kopması veya oluşması sırasındaki enerji değişimleri de genellikle 40 kJ/mol değerinden büyüktür. Fakat kesinlikle büyük olması gerekmez.
(D) b. Hidrojen bağı van der Waals sınıfı bir zayıf etkileşim değildir.
Açıklama: Zayıf etkileşimler içinde hidrojen bağları, van der Waals etkileşimlerinden daha sağlamdır. NH3, HF ve H2O bileşiklerinin kaynama noktalarının beklenenden yüksek olması bu durumu açıklar. Sonuç olarak asal gazların ve apolar moleküllerin yoğun fazlarında sadece London kuvvetleri bulunur ve fiziksel özellikler de etkilidir. Zayıf etkileşimlerde hidrojen bağlarının dışındaki bütün çekim kuvvetleri van der Waals kuvvetleri olarak tanımlanır.
(D) c. H2O molekülünde kalıcı dipoller bulunur.
Açıklama: Kalıcı dipol yapının oluşması için molekülün polar karakterde olması gerekir. Polar kovalent bağ içeren iki atomlu moleküllerde kalıcı dipoller vardır. Bir molekülde pozitif (+) ve negatif (–) yük merkezleri farklı olursa molekül polardır ve kalıcı dipoller vardır. H2O, NH3, H2S, PH3 gibi moleküller polardır ve kalıcı dipoller içerir.
(D) ç. Aynı veya farklı polar moleküller arasında dipol – dipol etkileşimi oluşur.
Açıklama: Polar yapılı moleküllerde, molekülün zıt kutupları arasında oluşan elektrostatik çekim kuvveti dipol-dipol etkileşimidir. H2O, H2S, NH3, HCl, HCN, PH3 gibi polar karakterli kovalent moleküllerde dipol- dipol etkileşimi görülür. Bir moleküldeki polarlık ne kadar fazla ise diğer moleküllerle arasında oluşan dipol-dipol etkileşimi o kadar büyük olur.
(D) d. Asal gazların yoğun hâllerinde London kuvvetleri etkindir.
Açıklama: Asal gazların ve apolar moleküllerin yoğun fazlarında sadece London kuvvetleri bulunur ve fiziksel özellikler de etkilidir. Polar moleküllerde London kuvvetleri ve dipol – dipol etkileşimleri bulunmasına rağmen kaynama noktasında dipol – dipol etkileşimi etkindir. London kuvvetleri, dipol – dipol etkileşimleri ve hidrojen bağı gibi zayıf etkileşimleri bulunduran NH3, HF ve H2O gibi bileşiklerde ise kaynama noktası gibi fiziksel özelliklerde hidrojen bağı etkindir. Ancak elektron sayısı çok olan apolar moleküllerde London kuvvetleri, dipollüğü yüksek olan polar moleküllerde de dipol – dipol etkileşimleri önem kazanır.
9. Sınıf Evrensel İletişim Yayınları Kimya Ders Kitabı Sayfa 125 Cevabı ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.












































