
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 180


“9. Sınıf Kimya Ders Kitabı Cevapları Sayfa 180 Meb Yayınları” ulaşabilmek ve dersinizi kolayca yapabilmek için aşağıdaki yayınımızı mutlaka inceleyiniz.
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 180
Etkinlik-2.21 Kaynayan Sıvıların Sıcaklıkları Neden Farklıdır?
Soru: Aşağıda periyodik tablo kesiti ve kesitteki elementlerin hidrojenli bileşiklerinin kaynama sıcaklıkları grafiği verilmiştir. Grafikteki verileri ve periyodik tablo kesitini kullanarak soruları cevaplayınız.
- Cevap:
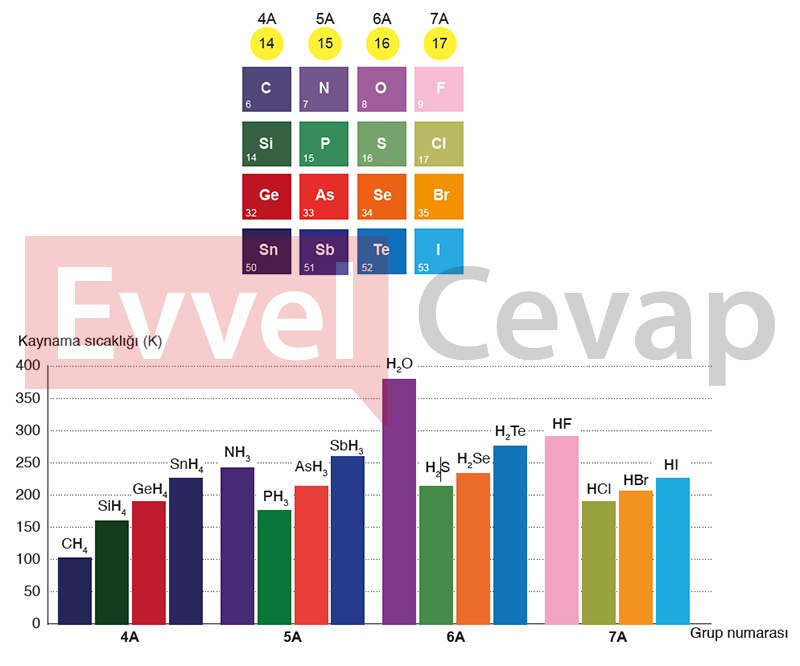
Soru: 4A grubu elementlerinin hidrojenle oluşturduğu bileşiklerin kaynama sıcaklığı nasıl değişmiştir? Bu değişimin nedenini moleküller arası etkileşim kuvvetlerini kullanarak açıklayınız.
- Cevap: 4A grubunda aşağıya doğru inildikçe elementlerin hidrojenli bileşiklerinin kaynama sıcaklığı artmıştır. 4A grubunda yukarıdan aşağıya inildikçe elektron yoğunluğu artar. London kuvvetleri artar ve böylece CH4, SiH4, GeH4 ve SnH4 sıralamasında bileşiğin kaynama noktası artar.
Soru: Aynı grup elementleri olan oksijen (O) ve kükürt (S) elementlerinin hidrojenli bileşiklerinde suyun (H2O) normal kaynama sıcaklığının hidrojen sülfürden (H2S) yüksek olmasının nedeni nedir? Moleküller arası etkileşim kuvvetlerini kullanarak açıklayınız.
- Cevap: H2O bileşiğinin kaynama noktasının H2S bileşiğinin kaynama noktasından büyük olmasının nedeni su moleküllerinin hidrojen bağı oluşturmasıdır. H2O ve H2S bileşiklerinin her ikisi de polardır ve dipol-dipol etkileşimlerini içerir ancak H2O molekülleri arasında hidrojen bağı olduğundan suyun kaynama noktası H2S bileşiğinin kaynama noktasından yüksektir.
9. Sınıf Meb Yayınları Kimya Ders Kitabı Sayfa 180 ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.












































